|
1. ПЦР в реальном времени: теория, варианты, возможности
Развитие молекулярно - биологических технологий
- 1868 год – первые данные о химических свойствах ДНК
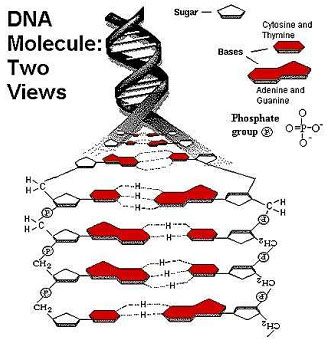
- Начало 50- годов XX в. – ДНК – это линейный полимер, состоящий из нуклеотидов, состоящих из азотистого основания, пентозы и фосфатной группы. Основания бывают двух типов: пуриновые – аденин и гуанин и пиримидиновые – цитозин и тимин.
- 1953 год – Д. Уотсон и Ф. Крик – нативная ДНК состоит из двух комплементарных полимерных цепей, образующих двойную спираль.
Развитие молекулярно - биологических технологий
- 1955 год – Артур Корнберг – открытие в клетках фермента – ДНК-полимеразы. ДНК-полимеразы обеспечивают репарацию и репликацию ДНК.
- 1959 год – А. Корнберг и Северо Очоа – Нобелевская премия по физиологии и медицине «за открытие механизмов биологического синтеза рибонуклеиновой и дезоксирибонуклеиновой кислот».
- 1962 год – Дж.Уотсон, Ф.Крик и М.Уилкинс – Нобелевская премия по физиологии и медицине за установление молекулярной структуры нуклеиновых кислот и ее роли в передаче информации в живой материи.
- 1971 год – Клеппе и соавт. – данные, касающиеся состава ингредиентов реакционной смеси и принципы использования коротких искусственно синтезированных молекул ДНК-праймеров для получения новых копий ДНК.
- Начало 80-х годов – разработка автоматических синтезаторов ДНК.
История

Kary Mullis «Просто однажды ночью я наткнулся на решение»
- 1985 год - первая публикация, в которой использован метод ПЦР Kary Mullis и соавторов. Saiki, R.K., Scharf S, Faloona F, Mullis K.B., Horn G.T., Erlich HA, Arnheim N., 1985. Enzymatic amplification of b-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia, Science 230, 1350.
- 1993 год - Нобелевская премия в области химии Kary Mullis.
- 1992 год - первая публикация Higuchi и соавторов, в которой использован метод ПЦР в реальном времени. Higuchi, R., Dollinger, G., Walsh, P.S., Griffith, R., 1992. Simultaneous amplification and detection of specific DNA-sequences. Bio-Тechnology 10(4), 413–417

Что такое ПЦР?
Полимеразная цепная реакция (ПЦР) - метод, имитирующий естественную репликацию ДНК, "in vitro" аналог биохимической реакции синтеза ДНК в клетке. ПЦР позволяет найти в исследуемом материале небольшой участок генетической информации, заключенный в специфической последовательности нуклеотидов ДНК любого организма среди огромного количества других участков ДНК и многократно размножить его. ПЦР позволяет получить количество ДНК, достаточное для детекции.
Область применения:
- диагностика инфекционных заболеваний;
- диагностика онкологических заболеваний;
- диагностика генетических заболеваний;
- идентификация личности;
- диагностика патогенов в пище;
- диагностика ГМО и др.
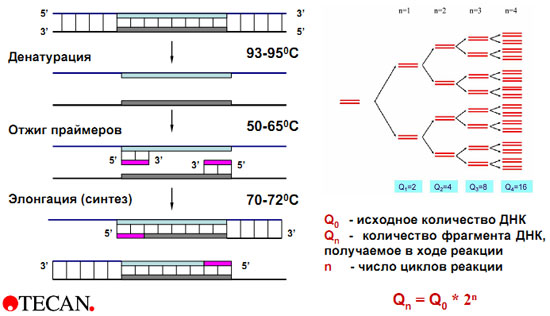
Схема ПЦР
ПЦР – циклический процесс, каждый цикл которого включает в себя три этапа, характеризующихся определенной продолжительностью и температурным режимом.
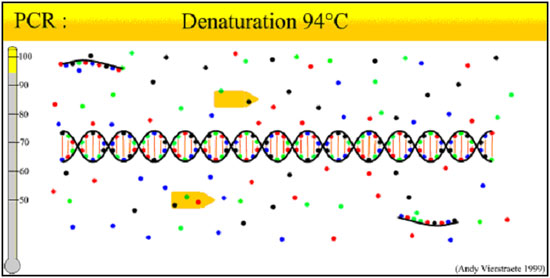
ПЦР: состав реакционной смеси
1. Целевая ДНК из образца любой природы (известная нуклеотидная последовательность) - ПЦР-мишень, которая будет многократно копироваться в ходе реакции.

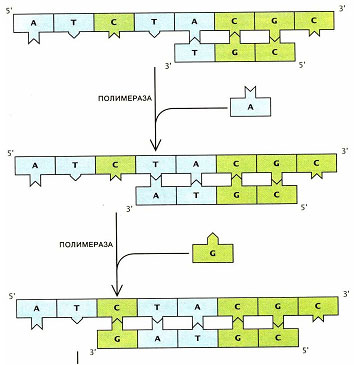
2. Праймеры – 2 искуственно синтезированных фрагмента ДНК, комплементарные районам, находящимся на противоположных нитях и фланкирующим искомую ДНК-мишень, с праймеров начинается удваивание цепи ДНК.

ПЦР: состав реакционной смеси
3. Термостабильная ДНК- полимераза – фермент, способный удлинять цепь ДНК.
4. Дезоксинуклеотидтрифосфаты (дАТФ, дТТФ, дЦТФ, дГТФ) – «строительный материал» для синтеза комплементарной цепи ДНК.
5. Реакционный буфер (с Mg2+) – буфер, создающий оптимальные условия (концентрация ионов и рН) для работы ДНК-полимеразы.
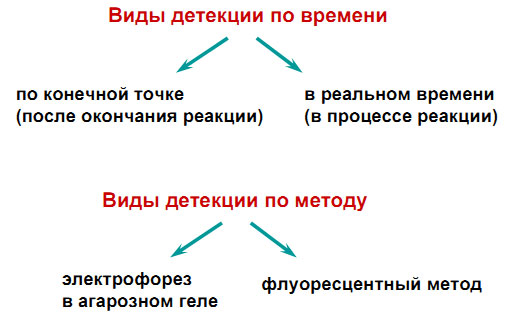
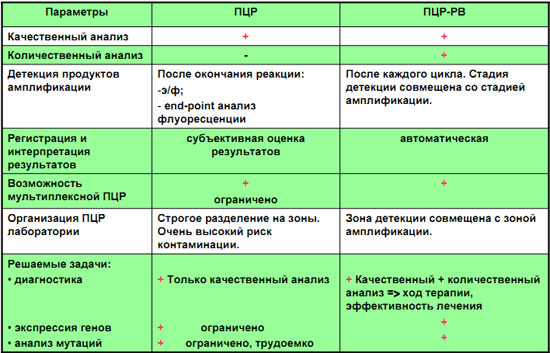
Виды детеции ПЦР - амплификации
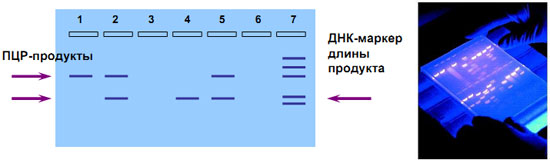
Электрофорез в агарозном геле
Детекция методом электрофореза в агарозном геле (только по конечной точке): разделение заряженных молекул (ДНК) в пористом геле в зависимости от их размера под действием электрического поля
- ДНК (ампликон) имеет отрицательный заряд - в электрическом поле движется от «-» к «+»
- Молекулы ДНК разного размера имеют различную подвижность в агарозном геле
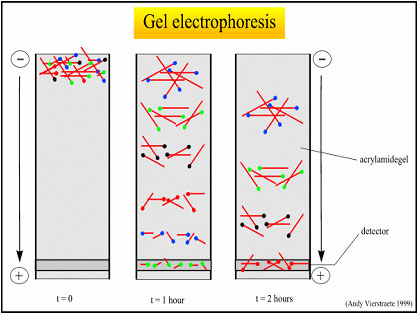
Размер ампликона можно оценить, сравнив его пробег с пробегом молекул ДНК известной длины
Электрофорез в агарозном геле
Преимущества:
1. Не требуется сложного оборудования
2. Низкая стоимость реактивов
Недостатки:
1. Высокий риск контаминации (загрязнения продуктами предыдущих ПЦР)
2. Требуется дополнительное помещение и персонал для стадии детекции продукта
3. Трудоемкость
4. Только качественный анализ (есть/нет)
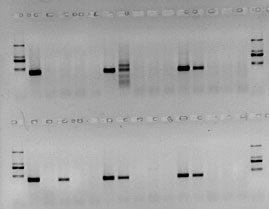
Флуоресцентный метод детекции
Флуоресцентный метод детекции по конечной точке (FLASH): пробирки с продуктами ПЦР анализируются специальным флуоресцентным детектором.
Преимущества:
1. Низкая стоимость оборудования для детекции
2. Низкая трудоемкость
3. Не требуется дополнительного помещения и персонала
4. Снижение риска контаминации
5. Автоматическая регистрация и интерпретация данных
Недостатки:
1. Только качественный анализ (есть/нет)
2. Более дорогие реактивы (по сравнению с форезом)
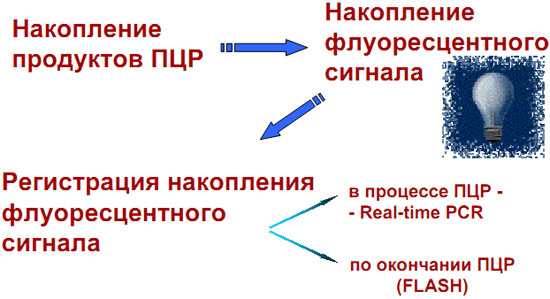
Что такое ПЦР в реальном времени (real-time PCR) ?
Флуоресцентный метод детекции в режиме реального времени
(real-time PCR):
- Определение выхода продукта после каждого цикла амплификации
- Построение по этим данным кинетической кривой ПЦР
- Определение относительной концентрации субстрата на основании анализа этой кривой
Стадия детекции совмещена со стадией амплификации.
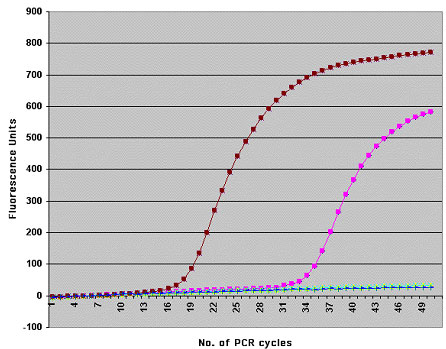
Кинетические кривые ПЦР в реальном времени
Кинетическая кривая ПЦР в координатах "Уровень флуоресценции — цикл амплификации" имеет сигмоидную форму.
В ней можно выделить три стадии:
Стадию инициации (когда ПЦР-продукты еще не детектируются флуоресцентной меткой);
Экспоненциальную стадию (в которой наблюдается экспоненциальная зависимость количества флуоресценции от цикла ПЦР);
Плато (стадию насыщения).
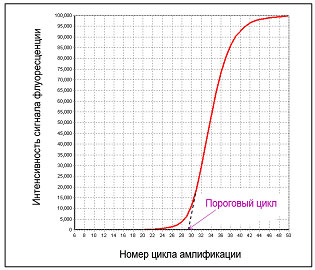
Пороговый цикл (threshold cycle, C(T)) такой цикл n, на котором достигается некий заданный уровень флуоресценции – пороговая флуоресценция.
Значение С(T) прямо пропорционально логарифму количества субстрата.
ПЦР-РВ позволяет сравнивать количества субстрата при условии, что эффективность реакции и заданный уровень пороговой флуоресценции одинаковы для каждой из сравниваемых реакций.
Сравнение ПЦР и ПЦР - РВ
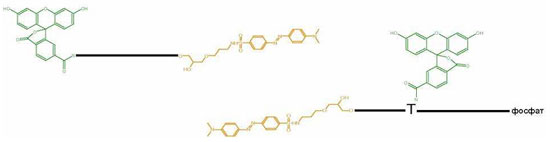
Флуоресцентные зонды
Делятся на две категории:
- использующие неструктурированные линейные зонды (TaqManTM, LightCycler, Lanthanide, EclipseTM);
- использующие структурные зонды (Molecular Beacons, ScorpionsTM , CycliconsTM).
красители на 5’ и 3’ концах зонда
один из красителей внутри цепи ( натимидине или цитидине)
Преимущества и недостатки систем ПЦР-РВ со специфической детекцией
Преимущества систем, использующих флуоресцентные олигонуклеотидные зонды:
- специфичность не ограничивается специфичностью праймеров, дополнительная специфичность за счет комплементарного зонда;
- возможность проведения мультиплексной ПЦР (до 4-х красителей);
- огромный выбор вариантов ПЦР-РВ.
Недостатки:
- сложный дизайн зондов и праймеров;
- высокая стоимость, т.к. на каждый фрагмент требуется свой специфический зонд.
Преимущества ПЦР-РВ
Основныепреимущества
- измерение исходного количества специфической ДНК (РНК) в исследуемом образце;
- широкий динамический диапазон от единичных до 109 копий;
- возможность сравнительного количественного анализа для нескольких различных ДНК-мишеней в одной пробирке одновременно;
- обнаружение и определение процентного содержания ДНК с измененной последовательностью;
- исключение послеамплификационных манипуляций с продуктом, и, как следствие, существенное снижение риска контаминации, сокращение времени анализа, упрощение организации ПЦР лаборатории;
- автоматическая регистрация и интерпретация полученных результатов.
Что необходимо для работы по технологии ПЦР в реальном времени:
- прибор для ПЦР-РВ;
- программное обеспечение;
- реактивы – наборы, тест-системы, праймеры и зонды;
- вспомогательное оборудование – центрифуги, вортексы, ламинар;
- расходные материалы – пробирки, стрипы, плашки.
2. Определение антибиотикоустойчивости
Особенности МБТ
- медленная скорость роста возбудителей;
- внутриклеточная локализация;
- высокая плотность (концентрация) клеток патогена (М.tuberculosis) в пораженном органе – до 10 млрд на легкое;
- способность клеток к переходу в фазу отсутствия роста с реактивацией через несколько лет;
- природная резистентность к ряду антимикробных агентов.
Все это приводит к хронической инфекции с необходимостью поддержания высокого уровня лекарственных препаратов в организме больного в течение ряда месяцев, в связи с чем обостряется проблема токсичности используемых лекарств.
Виды антибиотикоустойчивости
- Множественная лекарственная устойчивость (МЛУ или MDR – Multi-Drug Resistance) – вид устойчивости МБТ к двум основным ПТП – изониазиду и рифампицину одновременно (независимо от наличия резистентности к др. препаратам). 450,000 новых случаев туберкулеза с МЛУ - ежегодно.
- Экстенсивная или широкая лекарственная устойчивость – (XDR – Extensively Drug Resistant) множественная лекарственная устойчивость в сочетании с устойчивостью к фторхинолонам и к одному из группы инъекционных препаратов: канамицину или/и амикацину или/и капреомицину. 27,000 новых XDR случаев туберкулеза - ежегодно. Лечение XDR туберкулеза крайне трудно.
- Экстремальная или абсолютная лекарственная устойчивость – (XXDR – Extremely Drug Resistant) – устойчивость ко всем ПТП. В 2007 г. - первая публикация о двух зарегистрированных случаях абсолютно устойчивого туберкулеза (XXDR) в Италии.
- Перекрестная лекарственная устойчивость – явление, когда возникновение устойчивости к одному препарату влечет за собой устойчивость к другим ПТП. Обусловлена сходством химической структуры некоторых ПТП.
Диагностика лекарственной чувствительности/устойчивости
Классические
- Абсолютных концентраций
- Пропорций
- Метод коэффициента резистентности «Ускоренные» методы
- Бактек-960 (пропорций)
- Молекулярно – генетические
- ПЦР в реальном времени
- Биочип-технология
- Hain-test MDR-TB
- GeneXpert
Определение антибиотикоустойчивости с помощью ПЦР-РВ
Определение лекарственной чувствительности с помощью ПЦР-РВ – определение генных мутаций, ассоциирующихся с устойчивостью к определенным противотуберкулезным препаратам.
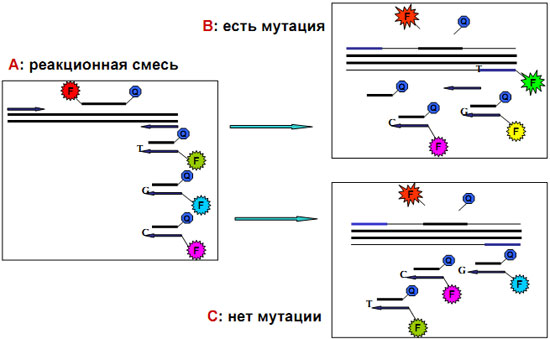
Аллель-специфичная ПЦР: для эффективной ПЦР 3’-концевой нуклеотид праймера должен быть комплементарен соответствующему нуклеотиду ДНК-матрицы, иначе эффективность удлинения праймера во время ПЦР резко снижается или может отсутствовать совсем.
Преимущество АС-ПЦР: позволяет получать информацию не только о наличии мутации в геномной ДНК, но и ее аллельном распределении.
АС-ПЦР в формате реального времени – возможность одностадийного быстрого и точного анализа мутаций !
Схема метода определения мутаций на основе технологии аллель-специфичной ПЦР-РВ
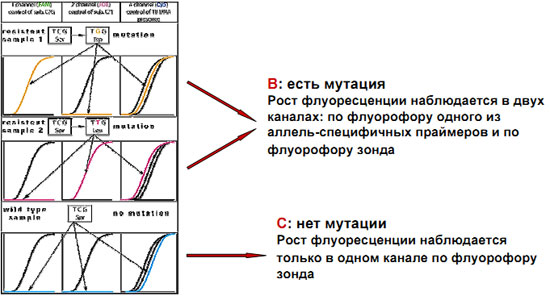
Интерпретация результатов выявления мутаций на примере 531 кодона rpoB гена M.tuberculosis
Апробация технологии мультиконкурентной аллель-специфичной ПЦР
- 2005 г. – испытания шифрованных тест-культур из супранациональной лаборатории Швеции; 2008-2009 гг. – ФСВОК испытания панели образцов на антибиотикоустойчивость
- 2006 г. – мониторинг более 2000 клинических образцов культур из 25 регионов РФ
- 2007 г. – клинические испытания шифрованных образцов мокроты
- 2007-2008 г. – регистрация в ГИСК им. Тарасевича
- 2007-2008 г. – разработка тест-систем, определяющих устойчивость к фторхинолонам, капреомицину, амикацину
- 2010 г. – получены регистрационные удостоверения на наборы М-СОРБ-ТУБ, АМПЛИТУБ-РВ, АМПЛИТУБ-МЛУ-РВ
Результаты мониторинга лекарственной устойчивости по федеральным округам РФ
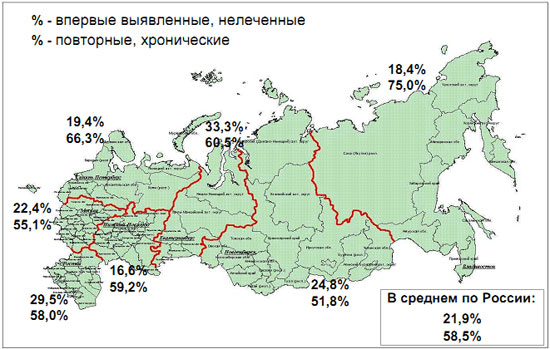
Сравнение ПЦР-РВ анализа и бактериологического исследования лекарственной устойчивости к RMP и INH
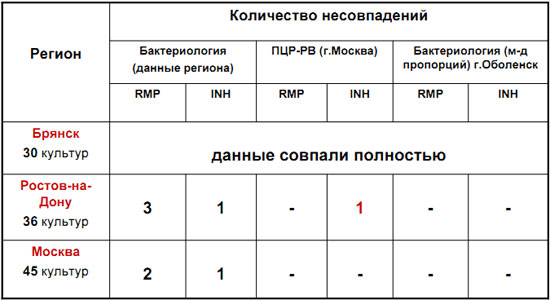
Совпадение результатов ПЦР-РВ и метода пропорций 99.5%
Апробация технологии мультиконкурентной аллель-специфичной ПЦР-РВ
Разработанный метод мультиконкурентной аллель-специфичной ПЦР-РВ позволяет быстро (1-3 дня) определять антибиотикоустойчивость 90-100% потенциально устойчивых штаммов со специфичностью 99-100%.

Результаты сравнительных испытаний
Уровень совпадений результатов определения лекарственной чувствительности между культуральными исследованиями и методом ПЦР-РВ составил:
- по двум типам антибиотиков (фторхинолоны и капреомицин/амикацин) – 87%
- по фторхинолонам – 84,1%;
- по капреомицин/амикацину – 89,6 %.
Чувствительность анализа методом ПЦР-РВ, по сравнению с культуральным, составила 90% (фторхинолоны - 90%, капреомицин/амикацин – 90%).
Специфичность анализа – 98% (фторхинолоны - 96%, капреомицин/амикацин – 100%).
ПЦР-РВ технология
- возможность работы как с культурами, так и с клиническими образцами
- высокая специфичность метода позволяет анализировать смешанные штаммы
- автоматический расчет результатов анализа с указанием количества выявленного возбудителя в образце и конкретных мутаций, определяющих устойчивость к определенным препаратам
- открытая система (возможность использования реагентов разных производителей, возможность использования материала для всех задач комплексного анализа МБТ)
- требует 2 помещений при организации ПЦР-лаборатории
Выделение ДНК на примере реагентов производства компании Синтол
«М-СОРБ-ТУБ» для для ручного выделения ДНК

Сочетает сорбцию ДНК на магнитных частицах и осаждение ДНК в присутствии осаждающего реагента, специально разработан для выделения туберкулезной ДНК из клинического материала.
«М-СОРБ-ТУБ-АВТОМАТ» для автоматического выделения ДНК

Адаптирован для автоматического выделения ДНК микобактерий на роботизированных станциях TECAN
Выделение ДНК – на роботизированной станции TECAN
- снижает риск контаминации во время выделения практически до нуля
- существенно уменьшает трудоемкость процесса выделения
- экономически эффективная система (низкий расход пластика и реактивов)
- позволяет проводить стандартизированное выделение ДНК из клинических образцов
- специально разработан для выделения ДНК микобактерий из клинического материала и культуры клеток
- обеспечивает высокую эффективность выделения ДНК из клинических образцов мокроты
- выделение ДНК основано на сорбции ДНК на оригинальных магнитных частицах
- включает внутренний положительный контроль (ВПК), позволяющий контролировать ингибирование ПЦР-РВ и эффективность выделения
Заключение
В настоящий момент в Российской Федерации, согласно Приказу № 109 министерства здравоохранения, подтверждение диагноза для всех случаев туберкулеза, так же как и контроль эффективности лечения (ежемесячно), осуществляется методом посева.
Основным недостатком метода являются длительные сроки получения результатов (21-28 суток), обусловленные медленным ростом микобактериальной популяции.
Метод ПЦР позволяет за короткое время (несколько часов) провести одновременно качественный и количественный анализ как на сами микобактерии туберкулёза, так и на их лекарственную устойчивость.
Однако, постановка ПЦР анализа имеет высокие требования к чистоте эксперимента и профессионализму сотрудников.
Автоматическая роботизированная станция TECAN позволяет избежать многих трудностей возникающих на преаналитическом этапе, снизить до минимума риск контаминации и практически исключить «человеческий фактор».
Cкачать PDF презентацию
На главную |






































